海洋所在牡蛎温度适应信号级联通路方面获新进展
近日,中国科学院海洋研究所贝类适应进化与遗传育种团队在牡蛎温度适应相关信号转导通路方面获得系列进展,研究成果相继发表于国际学术期刊iScience, Communications Biology和Cell Communication and Signaling。
牡蛎是世界性养殖贝类,也是我国贝类养殖的传统支柱产业。近年来在全球范围内出现的周期性夏季大规模死亡已成为一个挑战牡蛎养殖产业的重要问题,研究耐温机制是解决上述产业难题的重要途径。海洋生物高温抗性机制复杂,过往研究显示能量代谢、细胞凋亡等多个生理代谢过程参与其中,并对众多下游效应基因开展了功能解析,但一直缺乏上游级联信号通路的认知。蛋白磷酸化作为一种广泛研究的蛋白翻译后修饰,通过影响蛋白结构、细胞定位以及互作等介导生物的应激信号转导,但其在海洋生物研究较为薄弱。
研究团队前期基于长牡蛎(相对热敏感)和福建牡蛎(相对热耐受)热胁迫磷酸化蛋白组学发现高温通过蛋白磷酸化调控能量代谢和细胞凋亡介导二者耐热性分化(Ecotoxicology and Environmental Safety,2023)。后续研究中,团队锁定糖酵解关键限速酶—丙酮酸激酶(PK),细胞凋亡关键执行者—半胱氨酸天冬氨酸蛋白酶3(Caspase3)和NF-κB通路核心调控因子—NF-κB抑制蛋白(IκBα)开展了磷酸化功能及上游调控通路解析。
研究团队发现抗性评估常用指标——PK的Ser11磷酸化水平在福建牡蛎热胁迫下显著上调,基于体内和体外分子及生化实验证实软体动物保守Ser11位点磷酸化可以增强其与底物结合能力进而显著提升PK酶活,最终促进ATP合成以用于热损伤修复。经典MAPK/ERK通路通过磷酸化该位点进而介导二者热胁迫下差异能量代谢能力[1]。
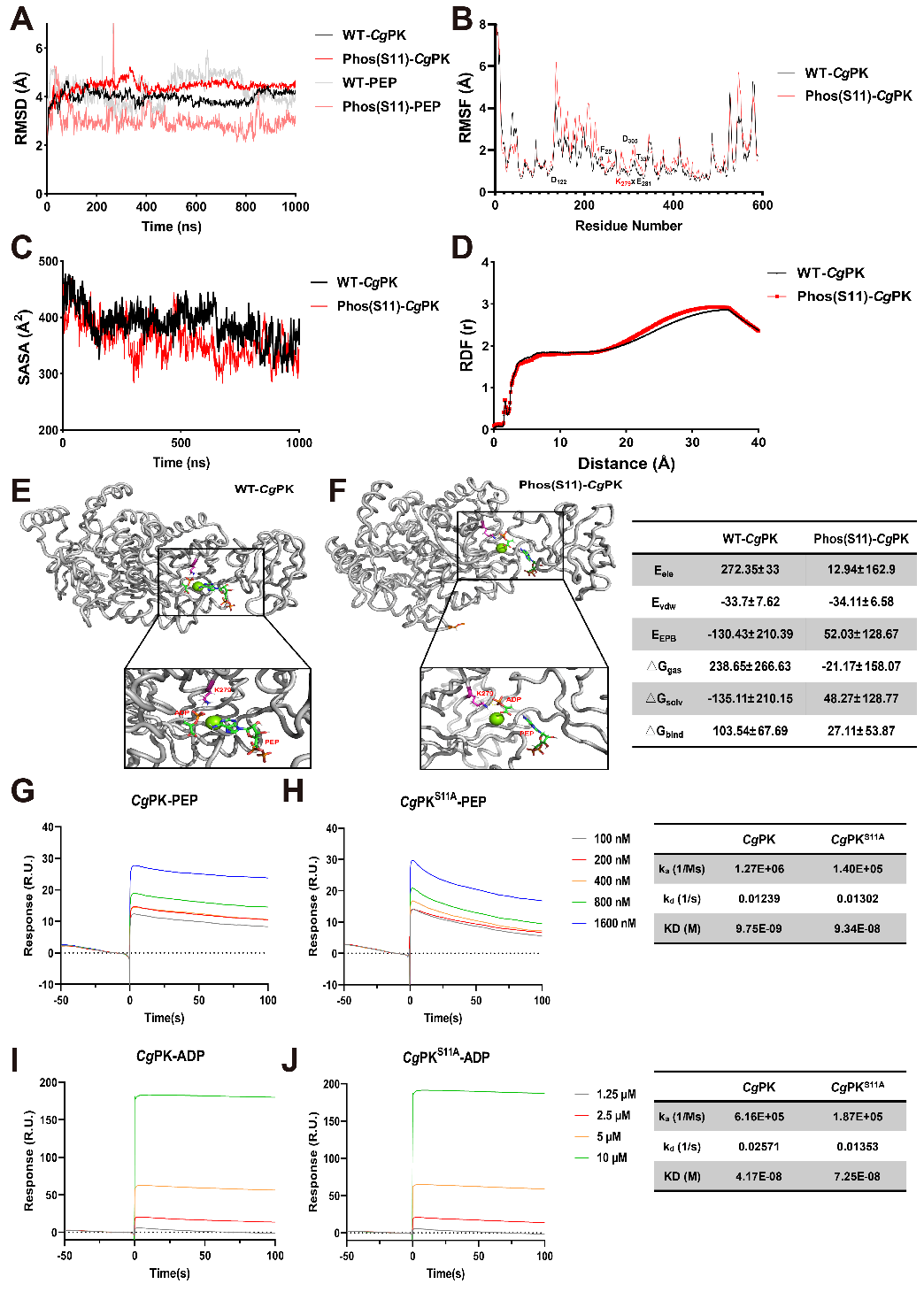
PK Ser11磷酸化与底物互作能力评估
团队针对差异磷酸化的Caspase开展系统发育分析,发现双壳纲和腹足纲中存在一类特异的Caspase-3/6/7蛋白,其具有长亚基间连接域(IL)并且长IL可以抑制其裂解激活。之前鉴定到的牡蛎保守Thr260磷酸化位点位于长IL中并抑制其热诱导裂解活化。经典PI3K-AKT通路直接磷酸化该位点从而调控长牡蛎和福建牡蛎热胁迫下差异凋亡[2]。
研究还发现NF-κB/IκB蛋白的Ser74位点磷酸化水平响应高温并在福建牡蛎中呈现更强的上调趋势。已知后生动物免疫明星通路——NF-κB信号通路的核心调控机制是IKK激酶磷酸化IκB的Ser32和Ser36位点,进而促进其泛素化-蛋白酶体降解和REL转录因子核转位及转录激活,而Ser74区别于上述保守位点,这暗示牡蛎NF-κB通路中可能存在新型磷酸化调控机制。团队后续研究结果证实牡蛎主效IκBα的Ser74是一个全新的牡蛎特异性热诱导磷酸化位点,该位点可以绕过S32和S36位点独立介导IκBα泛素-蛋白酶体降解和热稳定性降低。经典MAPK/ERK通路直接磷酸化该位点,并通过促进REL核转位来激活细胞存活、脂肪酸代谢、蛋白翻译和抗氧化基因表达以调控长牡蛎和福建牡蛎热胁迫下差异存活[3]。
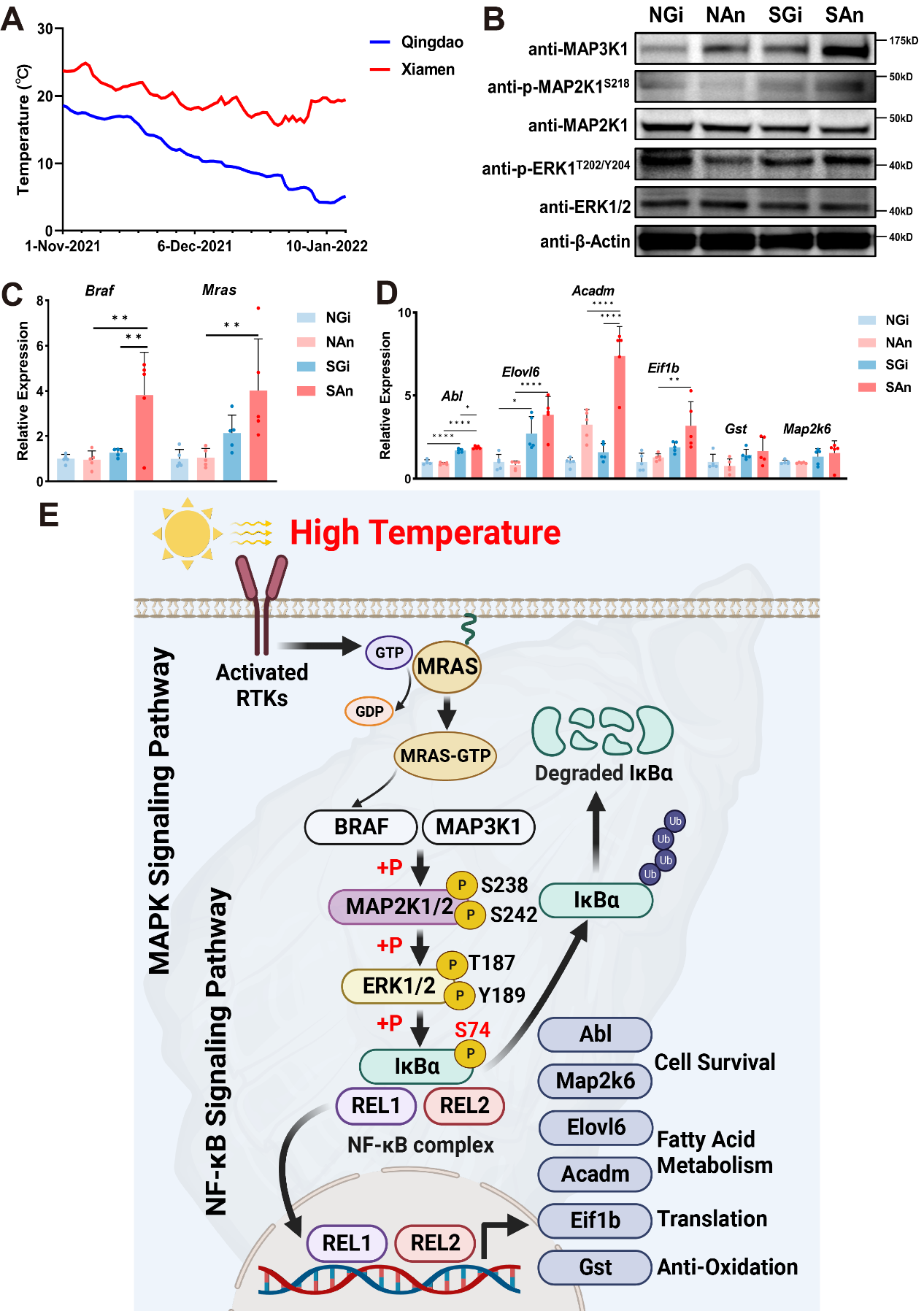
牡蛎MAPK/ERK/IκBα/REL调控轴
上述研究结果首次报道了多个海洋软体动物特异性的通路间串扰(Cross-talk)机制,进一步揭示海洋无脊椎动物中存在复杂且独特的磷酸化调控网络,其可能区别于模式动物中已建立的信号转导机制,并为后续牡蛎耐温性遗传改良提供分子靶标。
中国科学院海洋研究所博士后王朝刚为上述文章第一作者,在读博士生杜明洋和姜祝祥分别为论文共同第一作者,李莉研究员为通讯作者。本研究得到了国家重点研发计划、山东省重点研发计划、国家自然科学基金等项目的共同资助。
论文信息:
[1] Wang,C. et al. MAPK/ERK-PK(Ser11) pathway regulates divergent thermal metabolism of two congeneric oyster species. iScience, 27,110321,doi:10.1016/j.isci.2024.110321 (2024).
[2] Wang,C. et al. PI3K-AKT-mediated phosphorylation of Thr260 in CgCaspase-3/6/7 regulates heat-induced activation in oysters. Communications Biology, 7,1459,doi:10.1038/s42003-024-07184-4 (2024).
[3] Wang,C. et al. Novel Ser74 of NF-κB/IκBα phosphorylated by MAPK/ERK regulates temperature adaptation in oysters. Cell Communication and Signaling, 22,539,doi:10.1186/s12964-024-01923-0 (2024).
附件下载:
 鲁公网安备37020202001323号
鲁公网安备37020202001323号 | 古镇口园区地址:青岛市西海岸新区海军路88号 南海路园区地址:青岛市市南区南海路7号 科考船码头基地:青岛市西海岸新区长江东路8号 |
邮编:266000 邮件:iocas@qdio.ac.cn 电话:0532-82898611 传真:0532-82898612 |
