海洋所在甲壳动物抗病毒免疫的细胞和分子基础方面取得新进展
近日,中国科学院海洋研究所甲壳动物生殖与遗传工程研究组在甲壳动物抗病毒免疫的细胞和分子基础方面取得新进展,相关研究成果分别发表于国际期刊Journal of Advanced Research和PLoS Pathogens。
动物为抵御病原感染进化出复杂的免疫防御系统,其中淋巴器官是高等动物免疫系统的重要组成部分,它在调控淋巴细胞发育和免疫应答等过程中发挥关键作用。由于缺乏体细胞抗原受体重排和高度分化的淋巴谱系细胞,传统认为无脊椎动物不具有真正的淋巴器官。而在甲壳动物发现的类淋巴器官(也称为Oka)因其组织形态和病原响应特征与脊椎动物淋巴器官存在一定相似性而得以命名,但其是否具备脊椎动物淋巴器官的功能仍不清楚。另外,NLR作为动物先天免疫的重要胞内模式识别受体,由于其介导的“细胞焦亡”被发现以来便成为免疫学研究领域的“明星分子”。然而,甲壳动物作为生物学进化领域一个独特的分类单元,关于其NLR 的功能和作用机制的了解十分缺乏。
研究团队整合单细胞核RNA测序、跨物种比较分析及细胞毒性测试等多种技术手段,首次在对虾Oka中鉴定到组织特异性巨噬细胞样细胞、淋巴细胞前体样细胞和表达ZAP-70的自然杀伤(NK)样细胞,并发现上述细胞在白斑综合征病毒(WSSV)感染后发生聚集性迁移,形成Oka在病原感染后出现的特有组织学结构——淋巴器官球状体(lymphoid organ spheroid, LOS)细胞簇;此外,Oka中ZAP-70阳性细胞具有脊椎动物NK细胞的细胞杀伤活性。研究结果明确了对虾Oka在功能上与脊椎动物淋巴器官的相似性,为探索淋巴器官的起源与演化提供了重要证据。
另外,研究团队在甲壳类动物凡纳滨对虾中鉴定一种NLR 分子(LvNLRC),其可作为细胞内受体识别 DNA 病毒类似物,并通过调控 STING 介导的类干扰素通路参与抗病毒感染过程,并发现亲环蛋白A(LvCypA)可通过与LvNLRC直接互作调控上述过程。这种调控机制在动物NLR免疫调控领域尚属首次报道。研究结果不仅在甲壳类动物中鉴定出一种此前未被表征的细胞内病毒模式识别受体,还阐明了一种调控NLR免疫功能的新机制,为深入理解甲壳动物抗病毒免疫分子机制和NLR免疫调控机制提供了重要参考。
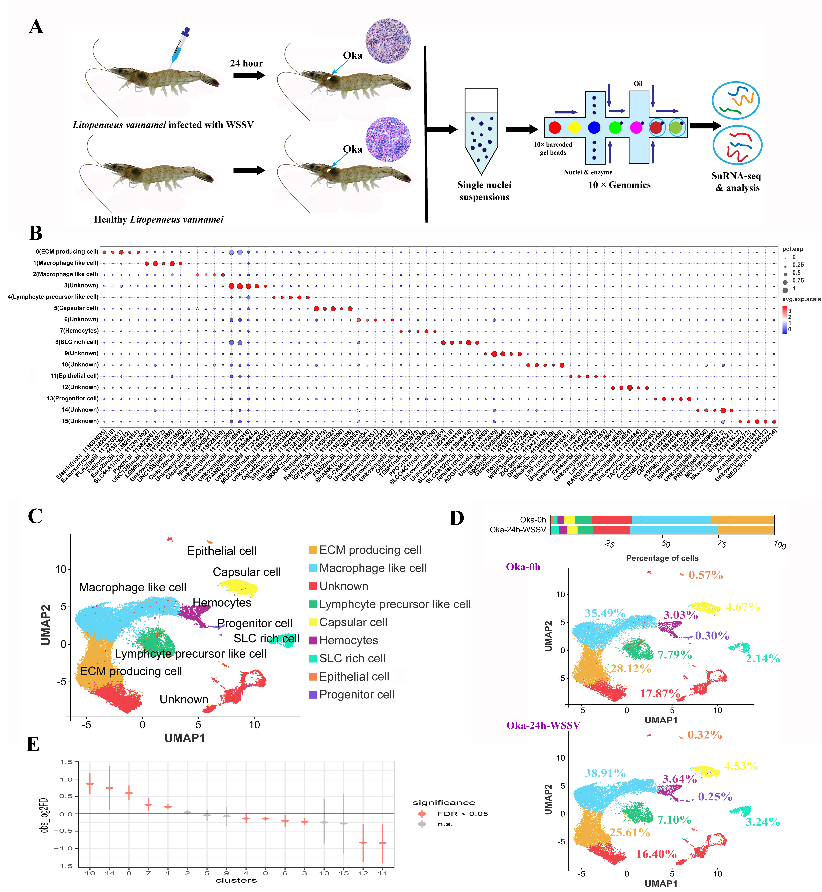
图1 Oka的细胞图谱
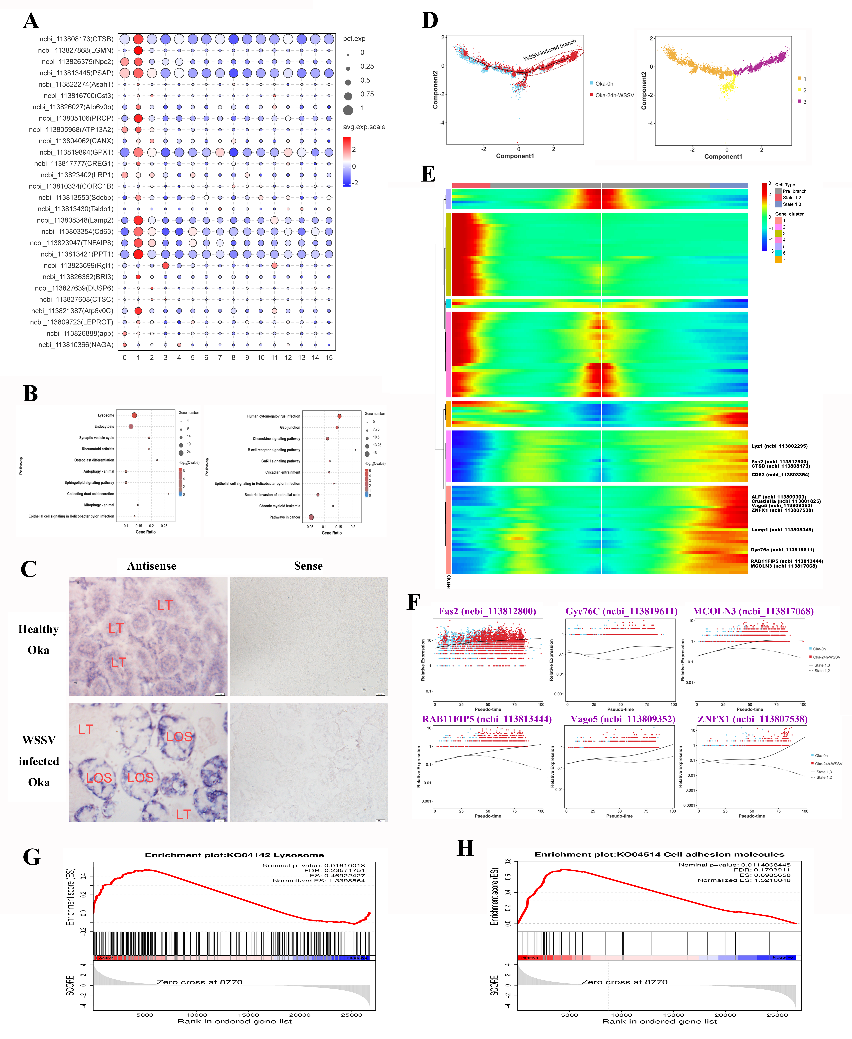
图2 WSSV感染引起巨噬细胞样细胞聚集迁移并诱发其抗病毒反应
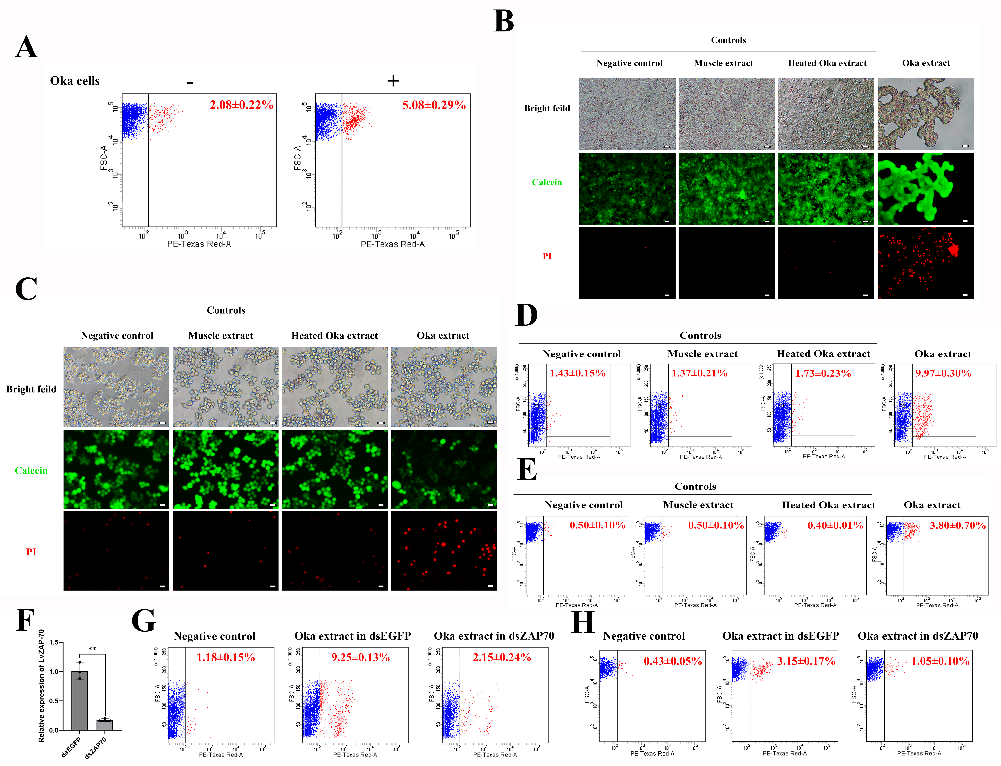
图3 Oka对异源细胞的细胞毒性活性
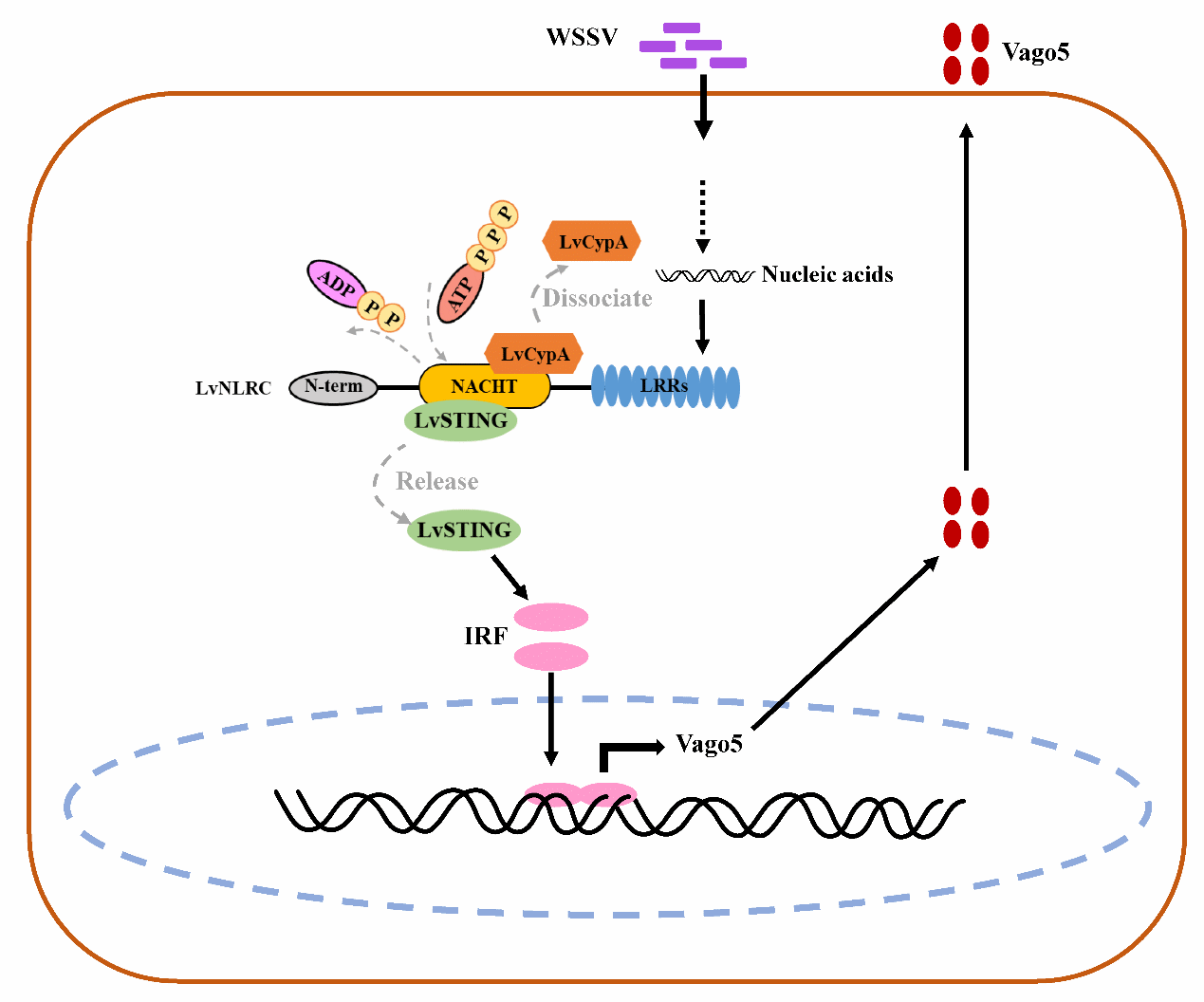
图4 凡纳滨对虾LvNLRC调控抗WSSV免疫的分子机制示意图
论文第一作者分别为中国科学院海洋研究所孙明哲助理研究员、李诗豪研究员等,李富花研究员等为论文通讯作者。研究得到中国科学院先导专项、国家自然科学基金和虾蟹产业技术体系等项目资助。
论文信息:
Mingzhe Sun, Shihao Li*, Yuan Liu, Fuhua Li*. Single-nucleus RNA sequencing illuminates a functional analog of lymphoid organ in crustacean. Journal of Advanced Research. 2025, In press. doi: 10.1016/j.jare.2025.11.018.
https://www.sciencedirect.com/science/article/pii/S2090123225009130
Shihao Li#, Xuechun Li#, Mingzhe Sun, Fuhua Li*. An invertebrate NLR recognizes viral nucleic acids and balances the antiviral signaling pathway through interaction with STING and Cyclophilin A. PLoS Pathogens, 2025, 21(8): e1013433. https://doi.org/10.1371/journal.ppat.1013433.
https://journals.plos.org/plospathogens/article?id=10.1371%2Fjournal.ppat.1013433
附件下载:
 鲁公网安备37020202001323号
鲁公网安备37020202001323号 | 古镇口园区地址:青岛市西海岸新区海军路88号 南海路园区地址:青岛市市南区南海路7号 科考船码头基地:青岛市西海岸新区长江东路8号 |
邮编:266000 邮件:iocas@qdio.ac.cn 电话:0532-82898611 传真:0532-82898612 |
